Главная страница
●
Основные положения
●
Кислотно-щелочное состояние
глава 1.3.1.
Буферные процессы
Теоретические
замечания
Буфер представляет собой смесь слабой кислоты с сопряженным с нею основанием.
Она находится в положении, способном выравнивать («забуферивать») концентрацию
ионов водорода.
Процесс «забуферивания» можно выразить математически. Выражение этих
взаимодействий вытекает из следующих рассуждений.
Угольная кислота диссоциирует частично на ионы водорода и гидрокарбоната:

Эта диссоциация по закону действующих масс формуляру-ется следующим образом:

Выделяя концентрацию ионов водорода, получаем:

Так как (Н+) равнозначно можно представить как значение рН или как отрицательный
десятичный логарифм, то далее следует:
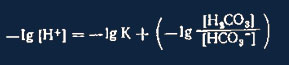
или
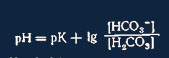
(уоавнение Henderson—Hasselbalch) Это уравнение Henderson—Hasselbalch можно
выразить совершенно равнозначно:

Если рК и рН равны, то буферные кислота и основание находятся в одинаковых
концентрациях. Значение рН при этом является и мерой силы кислоты: чем оно ниже,
тем сильнее кислота.
Примеры рК (Rausher с соавт.)
— угольная кислота 1-я ступень диссоциации 6,37 (25 °С)
— фосфорная кислота 1-я ступень диссоциации 2,12 (25 °С)
2-я ступень диссоциации 7,21 (25 °С)
3-я ступень диссоциации 12,66 (25°С)
— уксусная кислота 4,76 (25 °С)
— молочная кислота 3,86 (25 °С)
Примеры забуферивания
При голодании и диабетической коме образуются кетоновые тела
(бета-гидроксимасляная и ацетоуксусная кислоты). Они тотчас диссоциируют на ионы
водорода и кислотный радикал (бета-гидроксибутират и ацетоацетат). Эти
распавшиеся ионы водорода вели бы к значительному повышению [H+] (снижение
значения рН), если бы они не связывались с буферным основанием, например
гидрокарбонатом: гидрокарбонат после присоединения ионов водорода превращается в
угольную кислоту. При этом снижается концентрация гидрокарбоната. Место,
свободное от анионов, занимают анионы гидрокарбоната и бета-гидроксибутират и
ацетоацетат (рис. 7).

Рисэ 7. «Вытеснение бикарбоната» кетоновыми телами.
Если мы сформулируем результат этого процесса по уравнению
Henderson—Hasselbalch, то получим:
рН = 6,1 + lg(16/1.2) = 6,1 + 1,12 = 7,22
Без этого буферного действия значение рН упало бы значительно ниже. Буферная
система более эффективна, так как угольная кислота удаляется из организма
дыханием (открытая система!):
pH = 6,l + lg(16 /0.90) = 6,1 + 1,25 = 7,35
Снижение значения рН таким образом могло выравняться, если функция легких не
нарушена.
Буферная система организма.
Угольная кислота/гидрокарбонат
Эта система является важнейшей внеклеточной буферной смесью. Ее действие
значительно повышается вследствие того, что угольная кислота удаляется дыханием.
По уравнению Henderson—Hasselbalch, зная две величины, можно рассчитать третью,
например значение рН крови из соотношения гидрокарбонат/угольная кислота (рис.
8).
24 мэкв/л гидрокарбоната
рH = 6,1 + lg –––––––––––––––––––––
20 ммоль/л угольной кислоты
рН = 6,1 + lg(24/1,20) = 6,1 + 1,3 = 7,4

Бикарбонат
Рис. 8. Изображение соотношений уравнения Henderson — Hasselbalch в форме весов.
Там, где указано: «бикарбонат», нужно в уравнение Henderson — Hasselbalch
вводить действительную концентрацию бикарбоната плазмы. Для разъяснения роли
метаболических и респираторных процессов на рисунке с весами обозначена
стандартная концентрация бикарбоната. Это относится ко всем рисункам со
схематическим изображением весов.
Первичный и вторичный фосфат (Н2РО4— и HPO42—) 1
Эта буферная система для внеклеточного пространства практически не играет
никакой роли, а имеет значение для 1 внутриклеточного пространства и при
забуферивании мочи (см. 1.5.2).
Белки
Несмотря на большое количество ионизированных групп в молекулах белков, в
пределах значений pH организма буферной способностью обладают только
имидазольные группы гистидинов.
Гемоглобин I
В буферном действии рН молекулы гемоглобина имеет значение имидазольная группа
гистидина. Диссоциация этой! имидазольной группы зависит от насыщения кислородом:
оксигенированный гемоглобин отдает больше ионов водорода, чем
дезоксигенированный. Оксигемоглобин является более сильной кислотой и поэтому
более слабым буфером. После отдачи кислорода в процессе циркуляции гемоглобин из
оксигенированного превращается в дезокситенированныйл в результате буферная
емкость повышается. Это очень важно для присоединения угольной кислоты.
Буферное действие угольной кислоты (транспорт СО2 в крови)
В крови транспортируется: 5—6% двуокиси углерода в вида СО2 или НгСОз, 24% — в
виде карбоаминосоединений и 70% — в форме бикарбоната (Wahlin и соавт.).
Двуокись углерода, образующаяся в тканях, диффундирует в плазму тканевых
капилляров и физически там растворяется. В плазме малая часть (около 0,1%)
гидролизуется До Н2СО3. Следующая (небольшая) часть соединяется с аминогруппами
белков (карбоаминосоединения).
Рис. 9. Буферные механизмы вне- и внутриклеточного пространства при на-рушениях
кислотно-щелочного баланса (по Reissigl)

Большая часть растворенного СО2 диффундирует в
эритроциты. Благодаря карбоангидразе красных кровяных телец СО2 гидролизуется.
Образующиеся в процессе диссоциации ионы Н+ забуфериваются гемоглобином.
Одновременно повышающееся количество ионов НСО3— диффундирует в Плазму,
обмениваясь на Cl-ионы, до состояния равновесия, остальная часть СО2,
поступившего в эритроциты, образует карбоаминосоединения с гемоглобином. В
легких протекает обратный процесс.
Из рис. 9 видно, что буфер как внеклеточного, так и внутриклеточного
пространства выравнивает изменения концентрации ионов водорода. Минеральные
вещества костей также могут проявлять буферные свойства.
Разделение буферной емкости крови
1/5 буферной емкости приходится на кровь (Morgan). Деление на отдельные
буферные смеси в крови представлено в табл. 4.
Таблица 4. Относительная буферная емкость отдельных буферов в цельной крови
(Winters с соавт.)
|
Гемоглобин и
оксигемоглобин |
35% |
|
Органические
фосфаты |
3% |
|
Неорганические
фосфаты |
2% |
|
Белки плазмы |
7% |
|
Гидрокарбонат
плазмы |
35% |
|
Гидрокарбонат
эритроцитов |
18% |
copyright©surgerycom