Главная страница ● Нарушения водного, солевого и кислотно-щелочного баланса при различных патологических состояниях ● Шок (шоковый синдром)
глава 3.1.3.
Патогенез
В настоящее время наиболее тщательно исследованы нарушения при геморрагическом шоке. Эта форма шока неоднократно изучалась в экспериментах на животных, у которых можно регулировать кровопотерю, а также исследовать продолжительность и скорость развития шока (время до ретрансфузии, скорость выведения крови). Патогенез можно рассматривать на примере геморрагического шока.
Вагусная фаза (холодная кожа, гипотония, брадикардия)
Пульс в норме или замедлен (100—60 уд/мин), систолическое артериальное давление менее 100 мм рт. ст. Эта форма кратковременна и наблюдается редко (особая форма).
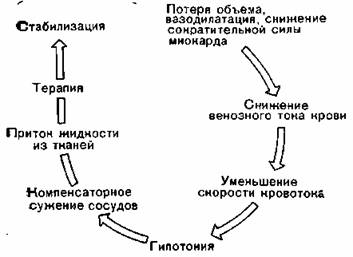
Компенсированный шок (холодная кожа, нормальное артериальное давление, тахикардия, начинающийся шок, фаза I; рис. 72)

Рис. 72. Фаза I течения шока по Ahnefeld и Allgower.
Признаки шока возникают лишь при внезапном уменьшении объема крови более чем на 20% (Ahnefeld, Franke).
Острое уменьшение объема крови вызывает симпатико-адренергическую реакцию.
— Существенное значение при этой реакции имеет сужение сосудов, обусловленное нейрогуморальными факторами. Ввиду неодинаковой симпатико-адренергической иннервации отделов сосудистой системы (особенно артерий) местная реакция оказывается различной, в связи с чем происходит регионарное перераспределение крови [Messmer, 1967, 1968].
Кровообращение вначале нарушается в коже, органах брюшной полости (область кровоснабжения a. mesenterica superior), в почках, печени, но не в сердце и головном мозге (Schneider);
— депо (например, селезенка) опустошаются;
— сила и частота сердечных сокращений повышаются, вследствие чего происходит мобилизация крови из легких;
— вены суживаются;
— артериовенозные шунты, например, в брюшной полости и в легких, открываются.
Благодаря этой селективной вазоконстрикции (централизации) артериальное давление стабилизируется, что гарантирует достаточное обеспечение кровью сердца и мозга.
При острой кровопотере до 20—25%, а иногда до 30% объема крови компенсации можно достигнуть путем нейро-гуморальной регуляции, а также благодаря притоку тканевой жидкости из интерстициального пространства в сосудистое русло. Существенное значение имеют исходное состояние, причина и интенсивность кровотечения (Moore). При этом интерстициальное пространство играет роль буфера для внутрисосудистого объема крови (исследования Shires с соавт.).
При недостаточном объеме крови из интерстициального пространства может уходить 20—30% воды. При предшествующей дегидратации эта важная компенсаторная возможность бывает ограниченной, что необходимо учитывать при проведении терапии. Таким образом, компенсаторную возможность определяет исходное состояние внеклеточного пространства. Дегидратация и дефицит натрия понижают толерантность к шоку (Moore).
Имеют значение и другие факторы риска: возраст, конституция, а также сопутствующие заболевания сердца, легких.
Симптоматика (рис. 73)
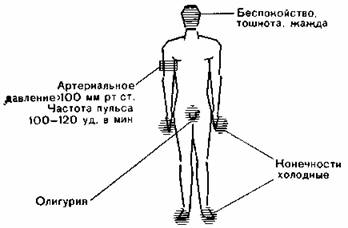
Рис. 73. Симптомы геморрагического шока (фаза I, холодная кожа, нормальное артериальное давление, тахикардия).
Систолическое артериальное давление пока превышает 100 мм рт. ст., амплитуда несколько уменьшена, диастолическое давление иногда повышено, пульс 100—120 уд/мин; конечности холодны на ощупь, лицо бледное, олигурия.
Декомпенсированный шок (холодная кожа, гипотония, тахикардия, выраженный шок, фаза II; рис. 74)
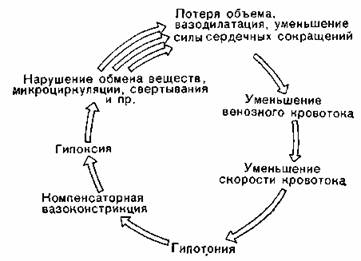
Рис. 74. Фаза II шока, модификация по Ahnefeld и Allgower.
При продолжающейся кровопотере (30% объема крови и более) артериальное давление у больного падает ниже 100 мм рт. ст. (при уменьшении объема на 40—50% оно более не определяется; Reissigl); его амплитуда сужена, пульс 120—140 уд/мин. Обращают на себя внимание одышка, бледные холодные конечности, покрытая потом кожа, цианоз губ, недостаточное наполнение вен, потемнение ногтевых лож, жажда, рвота, беспокойство, страх, олигурия/анурия.
Критическим является падение артериального давления ниже 100 мм, рт. ст. и учащение пульса выше 100 уд/мин (Reissigl, см. также индекс шока).
При уменьшении объема крови в таких пределах среднее давление падает настолько, что при нормальном или даже повышенном местном сопротивлении сосудистой стенки нарушается снабжение кровью сердца и мозга. Это ведет к нарастающей кислородной недостаточности. Частота сердечных сокращений увеличивается. Нарушение кровоснабжения жизненно важных органов без лечения ведет в конце концов к необратимым гипоксическим повреждениям («шоковая почка», «шоковая печень», «шоковое легкое», нарушения деятельности сердца и мозга). Возникает острая угроза жизни.
Новейшие исследования по шоку показывают, что эти гемодинамические нарушения в значительной степени усугубляются и другими факторами (Ahnefeld, Franke). Особенно имеют значение нарушения:
— обмена веществ,
— микроциркуляции,
— свертывания крови.
Они взаимно влияют друг на друга, образуя circulus vi-tiosus. Гипоксия является основным патологическим фактором. При определенной тяжести, которая не всегда точно устанавливается по клиническим симптомам, эти изменения прогрессируют.
Изменения обмена веществ (см. также Обмен веществ, 3.8.2.1)
Выявляются изменения в белковом, углеводном и жировом обмене. Вследствие уменьшения перфузии тканей развивается кислородное голодание организма. Нарушения газообмена в легких (увеличение «мертвого» пространства, артерио-венозные шунты, внутрисосудистые нарушения свертывания, ателектазы) усугубляют этот дефицит кислорода.
Кислородное голодание является причиной вначале обратимых, а позднее необратимых повреждений органов и активизации других патогенетических механизмов. Шок становится необратимым тогда, когда кислородная недостаточность в организме в течение времени достигает 120 мл/кг массы тела [Guyton, 1961].
По мере нарастания кислородного голодания сокращается конечное расщепление сахаров путем цитратного цикла. При этом накапливается пировиноградная кислота, которая при дефиците кислорода быстро превращается в молочную кислоту. Правда, благодаря блокированию микроциркуляции продукты метаболического ацидоза полностью не попадают в периферическую кровь. Эти изменения удается уловить только при помощи исследования тканевых проб и косвенно посредством определения кислых метаболитов, поступающих в кровь после нормализации микроциркуляции (феномен вымывания).
Далее происходит обеднение клеток фосфатами, богатыми энергией. При этом нарушаются все обменные процессы, протекающие с потреблением энергии.

Из 1 молекулы глюкозы образуется при гликолизе только 2 молекулы АТФ, напротив, в цитратном цикле, 38 молекул, т. е. в 19 раз большее количество энергии (Stapees с соавт.). Следовало бы указать, что регуляция кислотно-щелочного баланса затрудняется, так как шок влияет на функцию почек и легких. При геморрагическом шоке происходит потеря пеществ, обладающих буферными свойствами.
Микроциркуляция
Микроциркуляция является связующим звеном между макроциркуляцией и обменом веществ в клетках. Однако при шоке микроциркуляция в значительной степени зависит от макроциркуляции (сосудосуживающее влияние на пре- и посткапиллярные сфинктеры, образование артериовенозных шунтов). Это ведет к недостаточному обеспечению тканей кислородом и энергией, а также к уменьшенному тканевому дренажу (рис. 75, б в отличие от рис. 75, а, где представлена норма).
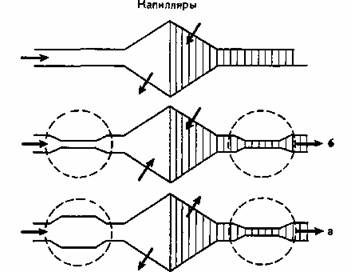
Рис. 75. Нарушения микроциркуляции (пояснения в тексте) (по Messmer, 1968).
Ацидотическое, токсическое и гипоксическое повреждение конечной части сосудистого русла приводит к его паралитическому расширению, повреждению мембран, вследствие которого из капилляров выводится значительное количество альбуминов и воды (повышение гематокрита и вязкости крови). Этот процесс усугубляется тем, что прекапиллярные сфинктеры открываются раньше всего (рис. 75, в). Капиллярное русло может расшириться иногда на 100% и более. Такое скопление крови обозначается как «запруда». В сосудах брюшной полости оно особенно выражено [Messmer, 1967]. В связи с этим процессом меняются свойства крови (например, вязкость), что влияет на микроциркуляцию и соответственно на перфузию тканей. Вследствие различных патологических процессов при шоке повышается вязкость крови. Например, причиной этого являются повышение гематокрита, потеря плазмы, особенно низкомолекулярного альбумина (приток в травмированные ткани, а также в области сосудистого стаза). Имеет также значение ускоренный катаболизм альбуминов при стрессе.
Исследования Gelin свидетельствуют о том, что нарушению микроциркуляции способствуют и другие факторы, которые обозначаются как феномен Sludge. В капиллярном русле наблюдается агрегация тромбоцитов (белый феномен Sludge), а на более поздних стадиях шока и агрегация эритроцитов (красный феномен Sludge).
Причиной этого, по-видимому, является замедление тока крови и изменение способности эритроцитов находиться во взвешенном состоянии. Агрегаты тромбоцитов вместе с клеточным детритом и лейкоцитами достигают 40 мкм. Если в одном из органов замедляется кровоток, то агрегаты появляются в крови. Это ведет к обратимой микроэмболии, особенно сосудов легких. Феномен Sludge еще более усугубляет нарушение микроциркуляции и обмена. До 40% эритроцитов могут подвергаться обратимой агглютинации и исключаться в связи с этим из циркуляции (Buchborn).
Нарушения свертывания крови
Нарушения свертывания крови особенно выражены при септическом и ожоговом шоке. У больных выявляются гиперкоагулопатия, процессы внутрисосудистого свертывания (вплоть до некрозов, особенно в области коркового слоя почек и в гипофизе; Neuhoff). Они ведут к падению числа тромбоцитов, а также афибриногенемии, т. е. к развитию коагулопатии потребления. Возникает последующее вторичное стимулирование фибринолитического потенциала.
Прочие факторы
В развитии декомпенсированного шока играют роль различные токсины. Они или возникают вследствие нарушенного, расщепления белков, или имеют бактериальное происхождение.
При шоке необходимо считаться с общим повышением протеолитического потенциала, которое ведет к образованию значительного количества полипептидов (Lefer, Martin), например каллидина и брадикинина. Эти кинины способствуют расширению сосудов, возбуждают гладкую мускулатуру и повышают проницаемость капилляров. Брадикинин и каллидин способствуют развитию симптомов шока. Наряду с этим имеет значение активация тканевых протеиназ (лизосомальных ферментов, например катепсина). Вследствие ишемии и других причин происходят разрыв лизосом и освобождение содержащихся в них тканевых протеиназ (Duve), особенно в области верхнего отдела тонкого кишечника [Messmer, 1968; Bitensky et al.]. При этом образуются кишечные токсины. Lefer, Martin находили при ишемии кишечника фактор, подавляющий деятельность сердца, химически относящийся к пептиду. Повышение протеолиза наблюдается также в поврежденных тканях (например, при ожогах).
Можно думать, что токсины влияют на ретикулоэндотелиальную систему, особенно печени и селезенки, антитоксическая функция которых вследствие недостаточного кровообращения и образования артериовенозных шунтов понижена.
На объем кровотока в единицу времени влияет также ухудшение сердечной деятельности, обусловленное кислородной недостаточностью и токсическим воздействием, особенно при наличии предшествующего заболевания сгрдца, а также нарушение структурных элементов центральной нервной системы (сосудорасширяющее действие).
Нарушения газообмена (см. 3.1.4), функции почек или печени, обусловленные шоком или предшествующими заболеваниями, возраст больного и другие факторы существенно влияют на течение, прогноз и летальность при шоке.
|
● |
● |
● |
● |
● |
● |
● |
● |
copyright©surgerycom