Главная страница ● Нарушения водного, солевого и кислотно-щелочного баланса при различных патологических состояниях ●
Операционный стресс
глава 3.8.2.1.
Адренергически-кортикоидная фаза
Ее биологический смысл заключается в том, чтобы повысить сопротивляемость организма в первую очередь посредством доставки, необходимых энергетических и материальных ресурсов.
Первая фаза характеризуется преобладанием тонуса симпатической нервной системы, а также повышением активности различных гормональных систем: коры надпочечников, мозгового слоя надпочечников, щитовидной железы и гипофиза.
Окончание адренергически-кортикоидной фазы характеризуется восстановлением перистальтики, появлением чувства голода, интереса к окружающему миру, к посетителям и т.д. [Moore, 1953]. Конкретно наблюдается следующее:
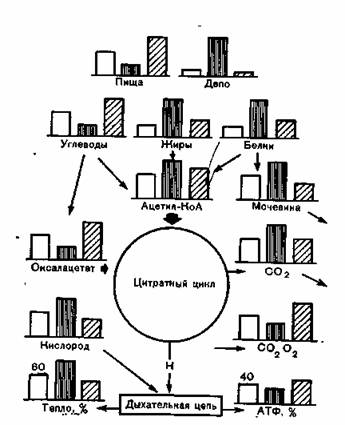
Изменения в энергетическом балансе (рис. 89)
В результате операции не возникает нового пути обмена веществ (Kinney), однако меняется интенсивность и значимость определенных процессов.

Рис. 89. Энергетический баланс в катаболической и анаболической послеоперационных фазах [Biinte, 1968].
Черные прямоугольники — катаболическая фаза, заштрихованные — анаболическая.
Энергетический обмен повышается (Kinney, Roe). Повышается потребность в кислороде, однако использование калорий на единицу кислорода уменьшается. Возникающая при процессах сгорания энергия в норме накапливается до 40% (например, в виде АТФ), а остальная теряется (Karlson). Эта процентная величина после операций и других травм уменьшается, обмен веществ частично нарушается [Bunte, 1968].
Примечательно изменение отношения утилизации основных питательных веществ к повышению сгорания белков и жиров, а также понижения усвоения углеводов. Вместе с тем считают, что «смесь горючих веществ» (сгорающие субстанции тела) состоит почти на 75% из обезжиренной массы тела (см. 1.1.1) и около 25% составляют жиры.
Изменение белкового обмена
Белковый обмен в адренергически-кортикоидную фазу характеризуется повышением процессов распада белка (повышенный катаболизм). Выражением интенсивного белкового обмена является азотурия, которая наблюдается как в послеоперационном периоде, так и после травмы.
Одновременно даже при нормальном диурезе выявляется повышение остаточного азота. Представление об изменениях белкового статуса (усвоение или потеря), обусловленных операцией, помогает составить баланс азота. Его можно определить по энтеральному и внутривенному поступлению азота и выведению его с мочой, калом, секретами и пр.) (рис. 90). Общая потеря белка после операций значительна. Например, у больных после резекции желудка в течение 10 дней после операции при неосложненном течении и без дополнительного парентерального питания она достигает в среднем 340 г. Это соответствует потере почти 1700 г обезжиренной массы тела. Редукция белковой части тела, несмотря на одинаковые условия перед, во время и после операции, имеет индивидуальные различия.
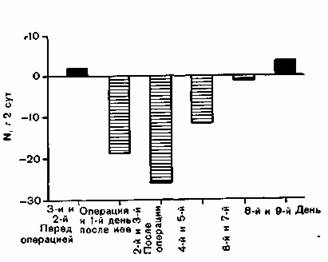
Рис. 90. Азотистый баланс у 12 больных после резекции желудка [Hartig, 1966].
При послеоперационных осложнениях (пневмония, перитонит, кишечная непроходимость и т. д.), при более крупных оперативных вмешательствах, ожогах, черепно-мозговой травме потери белка могут быть более значительными и продолжительными (табл. 23).
Таблица 23. Потеря белка после операций и травм
|
Вид операции или травмы |
Потеря белка, г/24 ч |
Потеря обезжиренной массы, г/24 ч |
|
Резекция желудка [Hartig, 1966] |
58 |
290 |
|
Грыжесечение (Rhoads, Alexander) |
11 |
55 |
|
Перелом длинных трубчатых костей (Rhoads, Alexander) |
86 |
430 |
|
Экстирпация матки через влагалище (Heller) |
38 |
190 |
|
Экстирпация матки абдоминальным путем (Heller) |
50 |
250 |
|
Черепно-мозговые травмы [Hartig et al., 1970 d,e] |
117 |
585 |
Эта потеря белка может представлять значительную опасность для больного в послеоперационном периоде, особенно тогда, когда у больных уже перед операцией был дефицит белка (о значении белков см. 1.2.4). При этом имеет значние не столько потеря мышечных белков, сколько потеря ферментных белков.
Наглядное представление о процессах белкового обмена дает следующая модель (рис. 91). Исходят из положения, что белок тела находится в динамическом состоянии. Процессы синтеза и распада взаимосвязаны. Все структурные белки подвержены постоянному использованию, превращению и распаду. Пул азота (так называемая лабильная смешанная фаза; Schoenheimer) связан внешним обменом с белками тела. При разработке представлений о белковом обмене нужно учитывать то, что различные органы и ткани в различной степени участвуют в белковом обмене, причем имеет значение объем тканей (общее количество белка), а также темп белкового обмена (Schoenheimer). Скорость обмена отражает полупериод распада белка. Белки печени, плазмы и желудочно-кишечного тракта распадаются очень быстро в отличие от белков поперечнополосатой мускулатуры. Особенно лабильны ферменты желудочно-кишечного тракта (рис. 92). После 24-часового периода воздержания от пищи большинство ферментов печени уменьшается более чем на 50%. После голодания нужно считаться с редукцией ферментов желудочно-кишечного тракта, что приводит к понижен ному усвоению пищевых белков при возобновлении питания естественным путем.
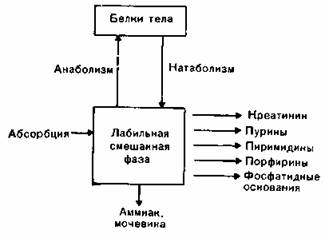
Рис. 91. Модель белкового обмена (по Rapoport).
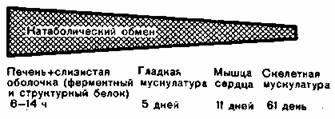
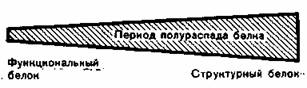
Рис. 92. Период полураспада различных белков организма и интенсивность катаболического обмена.

Рис. 93. Синтез и расщепление белка и белковый баланс у крыс под влиянием различных степеней стресса и условий питания (исследование с 15N-глицином).
Белые прямоугольники — величина синтеза, черные — величина расщепления, заштрихованные — баланс (соответственно в миллиграммах азота за сутки).

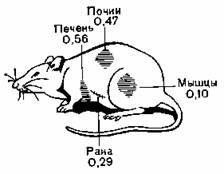
Рис. 94. Радиоактивность белков различных органов после пятидневного кормления через зонд в послеоперационном периоде меченным 15N аминокислотным раствором (15N — процент выведения).
В послеоперационном периоде различные органы и ткани страдают неодинаково. Особенно страдает пул лабильных белков (белков с коротким периодом полураспада).
Более глубокое представление об изменении белкового обмена после операций и других травм дает исследование радиоактивными изотопами (15N).
Не останавливаясь на подробностях, которые содержатся в оригинальных работах, можно на основании этих исследований сделать заключение (рис. 93):
— расщепление белка в организме при стрессе повышается; оно тем сильнее, чем тяжелее стресс (см. также табл.23).
— Одновременно при стрессе происходит синтез белка. Величину синтеза можно повысить посредством введения после операции белка или аминокислот. То, что после операции белок синтезируется, можно подтвердить и другими экспериментами, а именно путем определения 15N в белках печени, почек, мышц и ран после назначения в послеоперационном периоде 15М-меченных аминокислот в течение 5 дней [Hartig, 1966] (рис. 94). Эти наблюдения показывают, что адекватное питание в послеоперационном периоде влияет на зажив ление ран, а также на состояние защитных сил организма. Kult с соавт. (1975а), например, смогли быстрее компенсировать послеоперационный дефицит иммуноглобулинов (IgG, см. рис. 95) и компонентов комплемента после операций на органах брюшной полости путем достаточного парентерального питания.
— Баланс. Азотистый баланс ухудшается при стрессе вследствие повышенного распада белков тела. Однако его можно улучшить благодаря рациональному питанию больного в послеоперационном периоде, способствующему повышению синтеза белков тела.
При этом нужно учитывать, что при стрессе аминокислоты, вводимые энтерально и парентерально, в большем процентном количестве используются организмом для получения энергии, чем при некатаболических состояниях (см. также рис. 93).
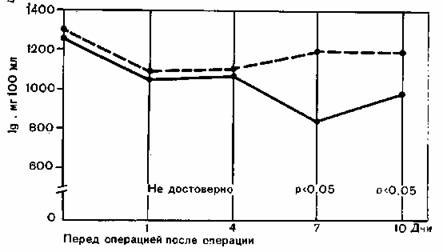
Рис. 95. Динамика концентрации иммуноглобулинов (IgG) в послеоперационном периоде в случае абдоминальных вмешательств (холецистэктомия, резекция желудка) при парентеральном питании (прерывистая кривая) и без него (сплошная кривая) [Kult et al., 1975a].
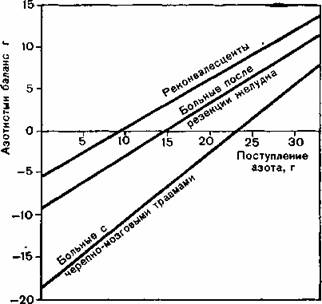
Рис. 96. Соотношения между питанием и азотистым балансом у реконвалесцентов [Hartig et al., 1971], у больных после резекции желудка (Со Тш et al) и при тяжелых травмах [Harticr et al; 1970d, e].
Соотношения между объемом питания, степенью травмы и балансом представлены на рис. 96: для достижения минимального отклонения баланса (баланс±0) нужно по мере усиления стресса постоянно увеличивать введение белка и соответствующего количества калорий (реконвалесцентам 59 г, больным после резекции желудка 91 г, больным с черепно-мозговой травмой 144 г белка в день). При воздержании от пищи реконвалесценты теряют 35 г, больные с резекцией желудка 58 г и с черепно-мозговой травмой 117 г белка в день. Данные у больных с черепно-мозговой травмой относятся к первым дням после травмы, а для больных с резекцией желудка — к первым 4 дням после операции.)1
Итак, если на основании изложенного можно улучшить баланс благодаря соответствующему питанию, то гораздо труднее при более тяжелом стрессе поддерживать положительный баланс на уровне катаболизма. Несмотря на это, любая степень изменения баланса в положительную сторону благотворно влияет на состояние больного в послеоперационном периоде.
Нужно полагать, что для поддержания белкового и энергетического баланса при определенных показаниях необходимо послеоперационное или посттравматическое питание парентеральным путем, а если возможно, то и энтеральное питание.
Напротив, анаболические гормоны, по нашим данным, в катаболической фазе не представляют ценности. Однако в анаболической фазе им отдается предпочтение.
Для практики важно знать: состояние белкового баланса имеет большое значение при проведении операции, а также в послеоперационном периоде. Стресс оказывает на него многообразное влияние. Интенсивное питание представляет собой важнейший метод поддержания и улучшения белкового обмена.
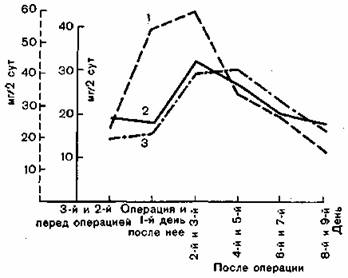
Рис. 97. Выведение 17-КС после операций резекции желудка и по поводу раковых опухолей (1), а также азота с мочой после резекций желудка (2) и операций по поводу злокачественных опухолей (3). Между повышением выведения стероидов остаточного азота имеет место тесная корреляция (Hartig, Czarnetzki).
Причины повышения катаболизма в послеоперационном периоде
Регуляция белкового обмена тесно связана с деятельностью промежуточного мозга, гипофиза и коры надпочечников (рис. 97). При этом предполагают, что гормоны коры надпочечников обусловливают не повышенную элиминацию азота, а повышенное расщепление белка. Основные исследования свидетельствуют о том, что наряду с центральными регулирующими влияниями за посттравматическое изменение белкового обмена ответственны и другие факторы. Эндокринно-метаболические реакции на травму в принципе одинаковы, но в деталях различны. Такие клинические особенности, как величина и характер раны, возраст, пол (Kinney с соавт.), состояние питания в предоперационном периоде, конституция больного, осложнения и пр., обусловливают течение обменных реакций на травму.
При значительных кровопотерях, некрозах, серьезных послеоперационных инфекциях наблюдается более значительная потеря белка (Abbott с соавт.). Менее выраженной потеря белка бывает при плохом питании больного в предоперационном периоде или после периода голодания (Hardy), Больные с развитой мускулатурой теряют больше белка. Иммобилизация также повышает потерю белка [Cutbertson, 1929]; ранняя активизация способствует его сохранению (Heller).
Изменения белков плазмы
Альбумины
На основании электрофоретических исследований было установлено, что количество альбуминов в послеоперационном периоде уменьшается [Eisenreich, Deininger, Flemming, Rothe, Hartig, 1966; Hartig et al., 1970; Hinrichs, Marggraf, 1952a,b; Kolbl et al., 1954; Major, 1952; Wenzl, 1950] в зависимости от объема операции. При этом уменьшается не только процентное содержание альбумина, но и абсолютное количество альбумина, циркулирующего в плазме [Hartig et al., 1970] (рис. 98).
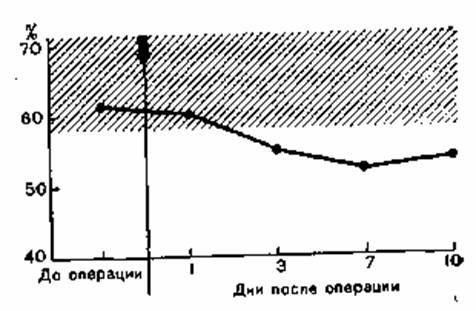
Рис. 98. Изменение альбумина плазмы в динамике послеоперационного периода после резекции желудка (результаты электрофоретических исследований) [Hartig, 1966].
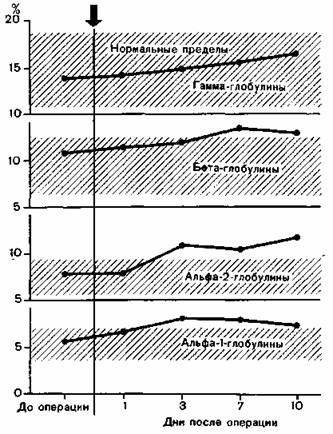
Рис. 99. Изменение отдельных фракций глобулинов плазмы в динамике послеоперационного периода после резекции желудка (результаты электрофоретических исследований) [Hartig, 1966].
После резекции желудка при неосложненном течении можно предполагать уменьшение общего содержания альбумина до 20%, что составляет у больного с массой тела 70 кг по меньшей мере 60 г альбумина. При послеоперационных осложнениях, а также при операциях большего масштаба потери больше.
После операции альбумин в организме расходуется на разные нужды. Вначале существенную роль играет повышенный катаболизм (см. выше). Затем альбумин устремляется в область ран и теряется при кровотечениях. Потеря альбумина зависит от размеров раневой поверхности, что особенно отчетливо проявляется, например, при ожогах. Щадящие операции способствуют сохранению альбумина. Подтверждением использования плазменного альбумина является обнаружение в область травмированных тканей повышенного количества альбумина и ускорение процессов его обмена [Hartig, 1970с].
Глобулины
При электрофоретическом исследовании выявляется повышение всех фракций глобулина плазмы, причем при более крупных оперативных вмешательствах обращает внимание наиболее выраженное повышение уровня а1- и а2-глобулинов [Hartig, 1966; Hartig et al., 1970с] (рис. 99). Другие исследования показывают, что повышается не только относительное, но и абсолютное содержание глобулинов плазмы [Hartig et al., 1970с].
Повышение содержания глобулинов в плазме идет не синхронно с падением содержания альбумина. Уровень альбуминов уменьшается непосредственно после операции, а повышение содержания глобулинов наблюдается только в более позднем послеоперационном периоде [Hartig et al., 1970с]. Это свидетельствует о том, что глобулины в послеоперационном периоде усиленно синтезируются. Вследствие этого защитный потенциал в более позднем периоде, согласно нашим исследованиям, повышается. Предпосылкой служит нормальный синтез глобулинов, на который влияют общее состояние белкового обмена и интенсивность питания в послеоперационном периоде [Kult et al., 1975a].
Изменения углеводного обмена
Изменения углеводного обмена характеризуются понижением толерантности к глюкозе (рис. 100).
Развивается диабетогенное состояние обмена веществ.
На основании такого изменения метаболизма углеводов при стрессовом состоянии большое значение придают применению многоатомных спиртов и сахаров, усвоение которых не требует инсулина (ксилитола, сорбитола, фруктозы) (более подробно эти данные изложены в 3.10.1).
Изменения жирового обмена
Они характеризуются, среди прочего, повышением липолиза (Schultis с соавт.). увеличением концентрации в плазме свободных жирных кислот, более высоким показателем сгорания жиров (см. рис. 89), а также увеличением образования кетоновых тел. Kinney с соавт. находили у женщин относитель^ но большее сгорание жира в рамках общего обмена веществ по сравнению с мужчинами. (Доля жира в теряемой массе тела с 1-го по 10-й день после операции у женщин составила 30%, а у мужчин 13%; Kinney с соавт.)
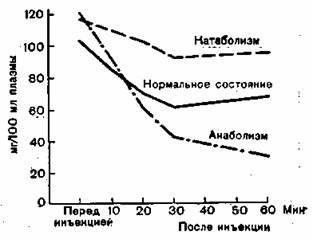
Рис. 100. Нагрузка инсулином (12,5 ME) у хирургических больных с нормальным обменом веществ в катабо-лической и анаболической фазах послеоперационного периода [Bunt, 1969].
Гиперкетонемия, наблюдаемая с 1-го по 4-й день после операции, рассматривается как проявление неполноценного использования жирных кислот. Из жирных кислот, которые расщепляются только до кетоновых тел, получается только 4 ккал (16,7 кДж) вместо 9 (Schultis и соавт.).
Вместе с тем нужно предполагать, что триглицериды непосредственно после операции утилизируются недостаточно, вследствие чего возникает кетогенная ситуация.
Изменения водного и электролитного баланса
Они обусловливаются, например, повышенной инкрецией альдостерона (послеоперационный гиперальдостеронизм), повышенным выделением вазопрессина, процессами трансминерализации, а также потерей калия, связанной с увеличенным распадом белков организма. Конкретно выявляются следующие изменения:
Олигурия
Наблюдается с 1-го по 2-й день после операции, реже и на 3-й день. Основными причинами являются: повышенное выделение вазопрессина вследствие анестезии, потеря жидкости, психический фактор, влияние медикаментов, усиленная реабсорбция натрия под влиянием альдостерона. Степень олигурии можно уменьшить адекватным возмещением объема плазмы, но полностью устранить ее нельзя (см. ниже). Отток мочи увеличивают также инфузиями растворов маннитола и сорбитола. Это особенно важно иметь в виду для тех больных, которым запланировано введение значительного количества жидкости после операции. Задержка воды в раннем послеоперационном периоде перекрывает потерю массы тела (Kin-пеу с соавт.) (рис. 101).
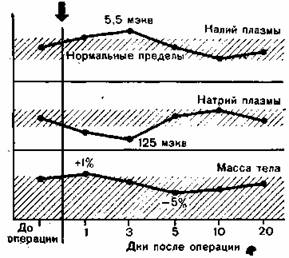
Рис. 101. Изменения водного и электролитного баланса в послеоперационном периоде [Bunte, 1971].
Задержка натрия
Наблюдается с 3-го по 5-й день после операции (положительный баланс натрия). Причиной является послеоперационный гиперальдостеронизм. Выведение натрия с мочой уменьшается.
Нужно помнить, что в стадию задержки натрия и воды в организме при избыточном введении натрия и воды возникает опасность отеков. Об этом нужно думать тогда, когда в послеоперационном периоде больные с олигурией чувствуют себя хуже, слабеют, появляются наклонность к рвоте и мозговые симптомы.
Считают, что при вмешательствах среднего объема в течение первых 4 дней после операции задерживается 100 мэкв натрия (Carstensen, Scheibe).
Увеличение выведения калия с мочой
На 2—3-й день после операции баланс калия отрицательный. Причиной являются гиперальдостеронизм, трансминерализация и расплавление тканей тела. При значительном введении натрия потеря калия возрастает. Считают, что при средних по объему оперативных вмешательствах потеря калия в первые 4 дня после операции составляет 90 мэкв (Carstensen, Scheibe). Страдает прежде всего мускулатура.
Увеличение выведния магния с мочой
Наблюдается на 2—5-й день после операции (Walker с соавт.).
Изменения состава плазмы
Они бывают нехарактерными. Большей частью определяется гипонатриемия (несмотря на задержку натрия в организме), обусловленная перемещением натрия в клетки, травмированные ткани, а также увеличением образования свободной от электролитов эндогенной воды. Содержание калия в плазме уменьшается, остается в норме или даже повышается.
Поразительное постоянство пре- и посттравматической потери калия наблюдалось у тех экспериментальных животных (крыс), которые перед стрессом подвергались физической тренировке. У нетренированных животных или у иммобилизированных в предтравматическом периоде потеря калия после стресса повышалась. Сообразно с этим мышечная тренировка должна улучшить исходное состояние больного перед оперативным вмешательством, гиподинамия, напротив, ухудшить (Steingass с соавт.).
Изменения кислотно-щелочного состояния
Метаболические влияния
Изменение обмена веществ в послеоперационном периоде ведет к повышенному образованию кислых продуктов вследствие как понижения усвоения углеводов и повышения сгорания жиров, так и повышения расщепления белков (рис. 102). Наряду с этим увеличивается концентрация молочной и пировиноградной кислот (Lindenschmidt), особенно в случае шока. Потеря гидрокарбоната из фистул может в значительной мере способствовать развитию ацидоза.
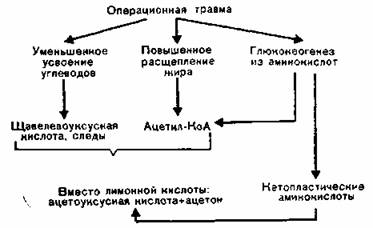
Рис. 102. Влияние операционной травмы на кислотно-щелочное состояние [Bunte, 1968].
Респираторные влияния
Нужно различать ранний и поздний ацидоз (Primer, Quarz). Ранний респираторный ацидоз возникает под влиянием анестезии, производных опия, вследствие недостаточного дыхания (раневая боль!) и пр.; поздний ацидоз вследствие задержки секрета в бронхах, ателектазов, пневмонических изменений, плеврального выпота и коллабирования оперированного легкого.
Необходимо помнить: в раннем послеоперационном периоде длительной гипервентиляции больным проводить не следует. В данном случае респираторное лечение освобождает от дыхательной работы.
|
● |
● |
● |
● |
● |
● |
● |
● |
copyright©surgerycom